அமிலம், காரம் மற்றும் உப்புகள் - I
* அமிலம் என்ற வார்த்தை அசிடஸ் என்ற இலத்தீன் மொழிச் சொல்லிலிருந்து எடுக்கப்பட்டது. இச்சொல்லின் பொருள் "புளிப்பு" என்பதாகும்.
* நீரில் கரைக்கும் பொழுது ஹைட்ரஜன் அயனிகள் கொடுக்கும் சேர்மம் அல்லது இடப்பெயர்ச்சி செய்யத்தக்க ஹைட்ரஜன் கொண்டுள்ள பொருள் அமிலம் ஆகும்.
*இருப்பினும் ஹைட்ரஜன் உள்ள எல்லாச் சேர்மங்களும் அமிலங்கள் அல்ல.
*(எ.கா): அம்மோனியா (NH3), மீத்தேன் (CH4)
வகைகள் :
மூலங்களின் அடிப்படை:
கரிம அமிலம் :
*தாவரங்கள் மற்றும் விலங்குளிலிருந்து பெறப்படும் அமிலங்கள் கரிம அமிலங்கள் எனப்படும்.
*(எ.கா): சிட்ரிக் அமிலம், பார்மிக் அமிலம்
கனிம அமிலம் :
*தாதுப்பொருட்களிலிருந்து பெறப்படும் அமிலங்கள் கனிம அமிலங்கள் எனப்படும்.
*(எ.கா): ஹைட்ரோ குளோரிக் அமிலம்
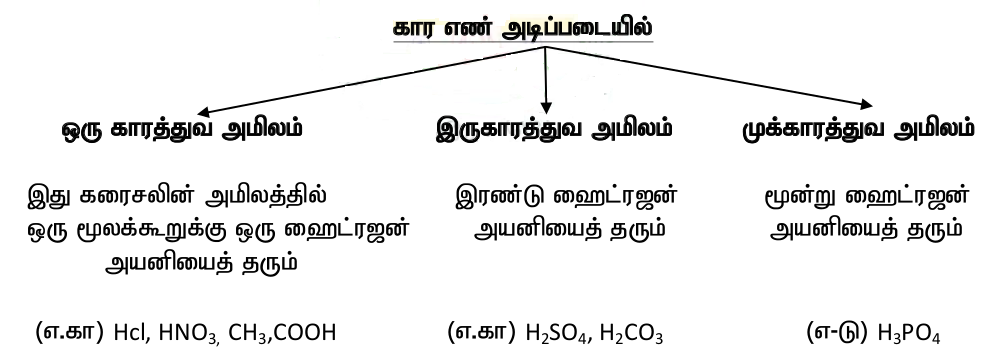
காரத்துவம் : இடப்பெயர்ச்சி செய்யக்கூடிய 'H' அணுக்களின் எண்ணிக்கை.
போலியோ தடுப்பு மருந்தை கண்டுபிடித்தவர் - ஜோனஸ்சால்க்
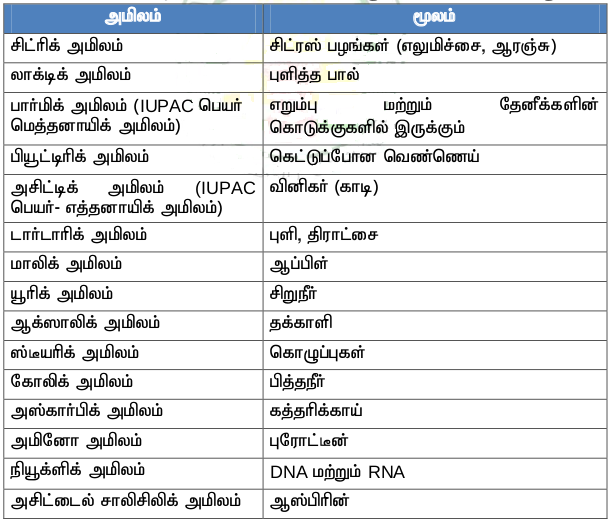
நம் அன்றாட வாழ்வில் பயன்படும் அமிலங்களும் அவற்றின் மூலங்களும் :
ஆய்வகத்தில் பயன்படுத்தப்படும் பொதுவான சில கனிம அமிலங்கள் :

அமிலத்தின் பண்புகள் (இயற்பியல் பண்புகள்) :
* கனிம அமிலங்கள் நிறமற்றவை சில வேளைகளில் கந்தக அமிலம் லேசான பழுப்பு நிறத்திலும், அடர் ஹைட்ரோகுளோரிக் அமிலம் இலேசான மஞ்சள் நிறத்தில் காணப்படுவதற்குக் காரணம் அவற்றில் உள்ள மாசுக்கள் ஆகும். சில கரிம அமிலங்கள் நிறமற்ற வெண்மையான திண்மங்களாகும்.
*(எ.கா): பென்சாயிக் அமிலம்
*சில கரிம அமிலங்கள் தவிர பெரும்பாலான அமிலங்கள், நீரில் கரையும் தன்மை கொண்டவை.
* கனிம அமிலங்கள் மிகுந்த அரிக்கும் தன்மை கொண்டவை. இவை தோலை அரிப்பதோடு உலோகங்களையும் அரிக்கும் தன்மையுடையவை.
* அமிலங்கள் புளிப்பு உடையவை.
* அமிலம் மின்சாரத்தை நன்கு கடத்தும்.
வேதிப்பண்புகள் :
1. அமிலங்கள் உலோகத்துடன் வினைபுரிந்து ஹைட்ரஜன் வாயுவை வெளியேற்றுகிறது .
*உலோகம் + அமிலம் -> உப்பு + H2 $\uparrow$ (பாப் 'pop' ஒலி எழுப்பும்)
(எ.கா):
*Zn+H2SO4 -> ZnSO4 + H2 $\uparrow$ (தீக்குச்சி கொண்டு சென்றால் அணைந்துவிடும்)
2. அமிலங்கள் காரங்களுடன் வினைபுரிந்து உப்பும் நீரும் உருவாகிறது. இவ்வினை நடுநிலையாக்கல் வினை எனப்படும்.
*அமிலம் + காரம் -> உப்பு + நீர்
(எ.கா):
*HCl + NaOH - Nacl + H2O $\uparrow$
3. அமிலங்கள் கார்பனேட் உப்புகளுடன் வினைபுரிந்து கார்பன் டை ஆக்சைடு வாயுவை வெளியேற்றுகிறது.
*Na2Co3 + 2Hcl -> 2Nacl + H2O+CO2 $\uparrow$ (தெளிந்த சுண்ணாம்பு நீரை பால் போல் மாற்றும்.)
தேசிய வேதியியல் ஆய்வகம் - புனே
உலகிலேயே வலிமையான அமிலம் - HFSO3 ஹைட்ரோ புளோரோ சல்பூரிக் அமிலம் (அ) புளோரோ சல்பூரிக் அமிலம்)
*லவாய்சியர்: ஆக்ஸிஜன் அனைத்து அமிலங்களுக்கும் அடிப்படை தேவை.
*டேவிஸ்: ஹைட்ரஜன்
*அர்ஹீனியஸ் : அமில - காரக் கொள்கை ஹைட்ரஜன் அயனிகளைக் கொடுக்கும் சேர்மங்கள் அமிலம் ஆகும். ஹைட்ராக்சைடு அயனிகளைக் கொடுக்கும் சேர்மங்கள் காரங்கள் ஆகும்.
*லௌரி & புரென்ஸ்டெட்: புரோட்டானை இழந்தால் அமிலம் ஆகும் (புரோட்டான் என்பது H+). புரோட்டானை ஏற்றால் காரம் ஆகும்.
காரத்துவம் :
* ஒரு மூலக்கூறு அமிலத்தில் எத்தனை இடப்பெயர்ச்சி செய்யும் ஹைட்ரஜன் அயனிகள் உள்ளனவோ அதுவே அந்த அமிலத்தின் காரத்துவம் ஆகும். (Basicity)
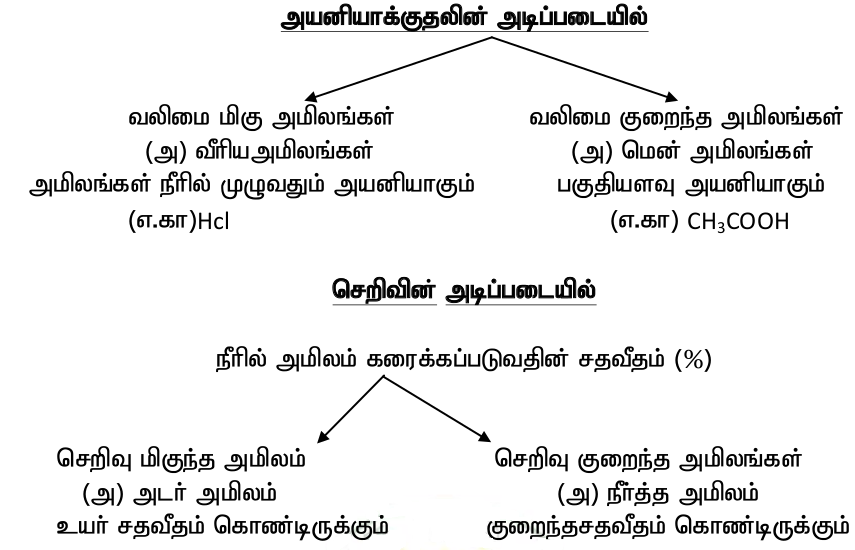
*வலிமை மிகுந்த அமிலம் : நீரில் கரைக்கும் போது முழுமையான பிரிந்து அயனிகள் தந்தால் அது வலிமை மிகு அமிலம் ஆகும்.
*அடர் அமிலம் : சேர்மத்தின் அமிலத்தின் செறிவு அதிகமாக காணப்படும்.
*நீர்த்த அமிலம் : சேர்மத்தின் அமிலத்தின் செறிவு குறைவாக காணப்படும்.
*அடர் அமிலம் நீர் --------> நீர்த்த அமிலம் (வெப்ப மீள்வினை)
அமிலத்தின் பயன்கள்
கனிம அமிலத்தின் பயன்கள் :
1. வேதியியல் ஆய்வு கூடங்களில் பயன்படுகிறது.
2. சாயம், உரம், வெடிபொருள் மற்றும் வாசனைத் திரவியங்கள் தயாரிக்க பயன்படுகிறது.
3.உலோகங்கள் தாதுக்கள் இருந்து பிரிக்க பயன்படுகிறது.
4. பெட்ரோலிய சுத்திகரிப்பில் பயன்படுகிறது.
கரிம அமிலத்தின் பயன்கள் :
1. உணவை பதப்படுத்த பயன்படுகிறது.
2. வைட்டமின் C தயாரிக்கவும், சமையல் சோடா தயாரிக்கவும் பயன்படுகிறது.
3. உணவு மற்றும் குளிர்பானங்களின் சுவையை கூட்ட பயன்படுகிறது.
