அமிலம், காரம் மற்றும் உப்புகள் - III
*பொதுவாக ஒரு அமிலமும் , காரமும் நடுநிலை ஆக்கல் வினைவில் ஈடுபடும் போது உருவாகும் அயனிச் சேர்மங்களே உப்புகள், நடுநிலையாக்கல் வினை நடைபெறும் பொழுது வெப்பம் வெளியிடப்படுகிறது.
*அமிலம் + காரம் -> உப்பு + நீர் + வெப்பம்
உப்புகளின் வகைகள் :
1.எளிய உப்புகள் :
*எ.கா: சோடியம் குளோரைடு, பொட்டாசியம் குளோரைடு, சோடியம் சல்பேட்
2. அமில உப்புகள் :
*எ.கா : சோடியம் பை சல்பேட், பொட்டாசியம் பை சல்பேட், சோடியம் பை கார்பனேட்
3.கார உப்புகள் :
*எ.கா: கார மக்னீசியம் குளோரைடு, கார லெட் குளோரைடு
4. இரட்டை உப்புகள் :
*எ.கா : பொட்டாஷ் படிகாரம், மோர் உப்பு
5. கலப்பின உப்புகள் :
*எ.கா: சோடியம் பொட்டாசியம் கார்பனேட், சலவைத்தூள்
6. அணைவு உப்புகள் :
*எ.கா: பொட்டாசியம், பெரோசயனைடு, சோடியம் ஜிங்க் சயனைடு
உப்புகளின் பொதுவான பண்புகள்
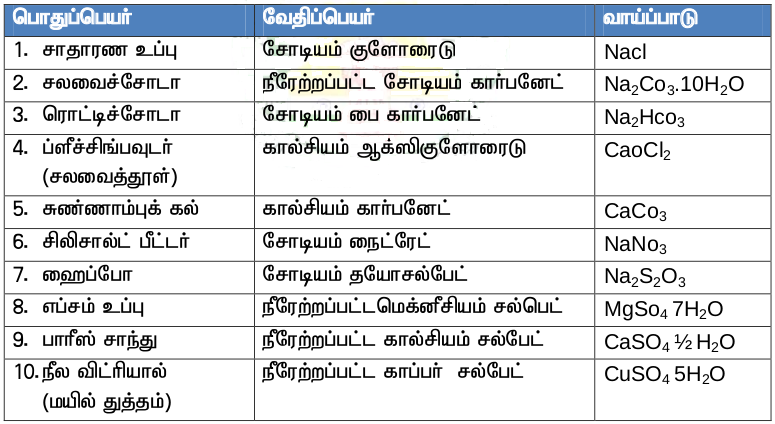
1. சோடியம், பொட்டாசியம் போன்ற உலோகங்களின் உப்புகள் நிறமற்றவை.
*எ.கா : Nacl, Kcl .
*ஆனால் காப்பர், இரும்பு, குரோமியம் போன்ற உலோகங்களின் உப்புகள் நிறமுடையவை.
எ.கா :
| *காப்பர் சல்பேட் | நீல நிறம் |
| *பொட்டாசியம் டைக்குரோமேட் | ஆரஞ்சு சிவப்பு நிறம் |
| *பெர்ரஸ் சல்பேட் | இளம் பச்சை நிறம் |
2. பொதுவாக உலோக உப்புகள் நீரில் கரையும் திறன் உடையவை. ஆனால் சில உலோகங்களின் கார்பனேட்டுகள், ஆக்ஸைடுகள், சல்பேட்டுகள் நீரில் கரைவதில்லை .
*எ.கா : கால்சியம் கார்பனேட்
3. பெரும்பான்மையான உப்புகள் அதிக உருகுநிலை கொதிநிலையும் உடைய திண்மங்கள்.
4. உலோக உப்புகளின் நீர்மக் கரைசல்கள் சிறந்த மின்கடத்திகள் ஆகும்.
அன்றாட வாழ்வில் பயன்படும் உப்புகள் :
உப்புகளின் பயன்கள் :
1. சோடியம் குளோரைடு (சாதாரண உப்பு) :
ஊறுகாய், மீன், இறைச்சி, காய்கறி போன்றவை கெடாமல் பாதுகாக்க பயன்படுகிறது.
2. சோடியம் பென்சோயேட் :
உணவு கெடாமல் பாதுகாக்க பயன்படுகிறது.
3. கால்சியம் கார்பனேட் :
சுண்ணாம்புக் கட்டி செய்ய பயன்படுகிறது.
4. சில்வர் நைட்ரேட் :
முடிச்சாயம் தயாரிக்கப் பயன்படுகிறது.
5. பாரில் சாந்து :
எலும்பு முறிவு சிகிச்சையில் பயன்படுகிறது.
6. ரொட்டிச்சோடா :
வயிற்றில் அமிலத்தன்மையைக் குறைக்கும் ஆன்டாசிட் மருந்துகள் தயாரிக்க பயன்படுகிறது.
7. சோடியம் நைட்ரேட் :
துப்பாக்கித் தூள் மற்றும் பட்டாசுகள் செய்ய பயன்படுகிறது
8.பொட்டாஷ் :
படிகாரம் தோல் பதனிடுதலிலும் காகிதங்களின் தரத்தை உயர்த்தவும், நிறமூன்றி யாகவும் பயன்படுகிறது.
pH அளவீடு :
* ஒரு கரைசலின் அமிலம் அல்லது காரத்தின் வலிமையை அக்கரைசலின் ஹைட்ரஜன் அயனிகளின் செறிவின் அடிப்படையில் அளவீடுதலே pH அளவீடு ஆகும்.
*pH மதிப்பு ஒரு கரைசலின் தன்மை அமிலமா, காரமா அல்லது நடுநிலையா என்பதைத் தீர்மானிக்கும்.
*S.P.L. சாரன்சன் என்பவர் இந்த pH அளவீட்டை அறிமுகப்படுத்தினார்.
pH மதிப்பைக் கீழ்க்கண்டவாறு கண்டறியலாம்:
pH = -log10[H+]
நடுநிலைக்கரைசலின் [H+] = 10-7M ; PH = 7
அமிலக்கரைசலின் [H+] > 10-7M ; PH < 7
கார கரைசலின் [H+] < 10-7M ; PH > 7
OH- அயனிகளைக் கருத்தில் கொண்டால் pOH கணக்கீட்டைக் கீழ்க்கண்டவாறு குறிப்பிடலாம்.
pOH = -log10[OH-]
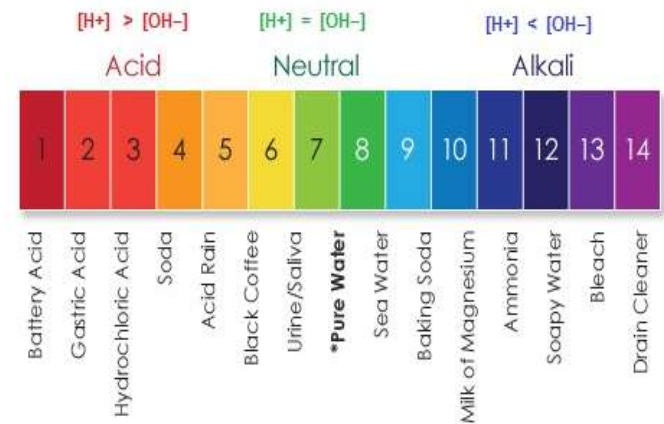
அ) [H+] > OH- - அமிலத்தன்மை அதிகரிக்கிறது
ஆ) [H+] < OH- - காரத்தன்மை அதிகரிக்கிறது
இ) [H+] = OH- - நடுநிலைத்தன்மை
அன்றாட வாழ்வில் pH ன் முக்கியத்துவம் :
1.மனித உடலில் pH:
*pH மதிப்பைக் கொண்டு மனிதனின் உடல் நலம் கணிக்கப்படுகிறது. PH ன் மதிப்பு 6.9 ஆகும் போது குளிர், இருமல் மற்றும் ப்ளூ இவற்றின் தாக்கத்திற்கு ஆளாகிறது.
* pHன் மதிப்பு 5.5 ஆகும் போது புற்றுநோய் செல்கள் உடலில் தோன்றி உயிர் வாழ ஏதுவாகிறது.
* தோலின் pH மதிப்பு 4.5 லிருந்து 6 ஆக இருக்கும்.
* வயிற்றில் சுரக்கும் திரவத்தின் pH மதிப்பு கிட்டத்தட்ட 2 ஆக இருக்கும். இது உணவைச் செரிமானம் செய்ய உதவுகிறது.
* மனித ரத்தத்தின் pH 7.35 விலிருந்து 7.45 ஆக இருக்கும்.
* உமிழ்நீரின் pH 6.5 லிருந்து, 7.5க்குள் இருக்கும்.
* பற்களிலுள்ள எனாமல், உடலில் கடினமான பகுதியாகும். இது கால்சியம் பாஸ்பேட் என்ற சேர்மத்திலானது. உமிழ்நீர் pH 5.5 க்குக் கீழ் குறையும்போது எனாமல் அரிக்கப்படுகிறது. பற்களை சுத்தப்படுத்தும் பற்பசைகள் காரத்தன்மை பெற்றிருக்கும்.
2. மண்ணின் pH :
* சிட்ரஸ் பழங்கள் காரத்தன்மையுடைய மண்ணிலும், அரிசி அமிலத்தன்மையுடைய மண்ணிலும், கரும்பு நடுநிலைத்தன்மை உடைய மண்ணிலும் விளைகின்றன.
3. மழைநீரின் pH :
* இதன் pH 7 ஆகும். ஆனால் SO2, NO2 போன்ற வாயுக்களால் மாசுபடும் பொது இதன் pH 7 விடக் குறைந்து அமில மழை உருவாகிறது.
| கரைசல் | pHன் மதிப்பு |
|---|---|
| எலுமிச்சை சாறு | 2.2 - 2.4 |
| தக்காளிச் சாறு | 4.1 |
| காபி | 4.4 - 5.5 |
| மனிதனின் உமிழ்நீர் | 6.5 - 7.5 |
| வீட்டில் பயன்படுத்தப்படும் அம்மோனியா | 12 |
கோபர் வாயுவில் மீத்தேன் உள்ளது.
கணக்கீடுகள்:
1. ஒரு கரைசலின் ஹைட்ரஜன் அயனியின் செறிவு 0.001M எனில் அக்கரைசலின் pH மதிப்பைக் கண்டு பிடிக்கவும்.
தீர்வு :
pH = -log10[H+]
pH = -log10[0.001]
pH = -log10(10-3)
pH = (-3)-log1010
pH = 3
2. ஒரு கரைசலின் ஹைட்ராக்சைடு அயனியின் செறிவு 0.001M எனில் அக்கரைசலின் மதிப்பைக் கண்டுபிடிக்கவும்.
தீர்வு :
pOH = -log10[OH-]
pOH = -log10(10-3)
pOH = 3
pH = 14 - pOH
pH = 14 - 3
pH = 11
