தனிமம் மற்றும் சேர்மம் - II
* இரண்டு அல்லது அதற்கு மேற்பட்ட தனிமங்கள் ஒரு குறிப்பிட்ட நிறை விகிகத்தில் இணைந்து உருவான பொருளே சேர்மம் எனப்படும்.
வகைப்பாடு :
கனிமச் சேர்மம் :
*பாறை, தாதுக்கள் போன்ற உயிரற்ற மூலங்களிலிருந்து பெறப்படும் சேர்மங்களாகும்.
*எ.கா: சமையல் சோடா, சுண்ணாம்புக்கட்டி (Chalk), பளிங்கு.
கரிமச் சேர்மங்கள் :
*தாவரங்கள், விலங்குகள் போன்ற மூலங்களிலிருந்து பெறப்படும் சேர்மங்கள் கரிமச் சேர்மங்கள் ஆகும்.
*எ.கா : சர்க்கரை (Sucrose), புரதம் (Protein), மெழுகு (Wax), எண்ணெய் (Oil).
சேர்மத்தின் சிறப்பியல்புகள் :
* இரண்டு அல்லது அதற்கு மேற்பட்ட தனிமங்கள் ஒரு குறிப்பிட்ட நிறை விகிதத்தில் வேதியியல் முறையில் இணைந்து சேர்மம் உருவாகும்
*எ.கா : நீரில் ஹைட்ரஜனும், ஆக்ஸிஜனும் 1: 8 என்ற நிறை விகிதத்தில் உள்ளன .

* ஒரு சேர்மத்தில் உள்ள பகுதிப் பொருட்களை இயற்பியல் முறைப்படி பிரிக்க இயலாது.
*வேதியலைப் பொருத்து தனிமங்களாகப் பிரிக்கலாம்.
* ஒரு சேர்மம் உருவாகும் போது வெப்பம் வெளியிடுதலோ அல்லது உறிஞ்சுதலோ நிகழ்கின்றது.
* ஒரு சேர்மம் குறிப்பிட்ட உருகுநிலை மற்றும் கொதிநிலையைப் பெற்றிருக்கிறது .
* சேர்மத்தின் பண்புகள் அதன் பகுதிப் பொருள்களின் பண்புகளிலிருந்து மாறுபடுகின்றன .
* சேர்மம் ஒரு படித்தானது.
சேர்மங்களின் பயன்கள் :
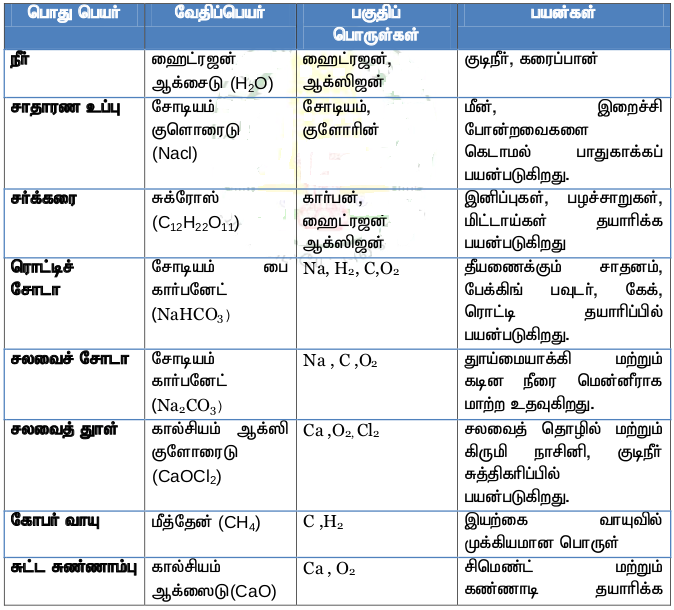

அணுக்கட்டு எண் :
*ஒரு தனிமத்தின் ஒரு மூலக்கூறில் எத்தனை அணுக்கள் உள்ளனவோ அதுவே அத்தனிமனத்தில் அணுக்கட்டு எண் ஆகும்.
அணுக்கட்டு எண் ஒன்று :
*சில்வர், பொட்டாசியம், கார்பன் மற்றும் மந்த வாயுக்கள்
அணுக்கட்டு எண் இரண்டு :
*ஹைட்ரஜன், புரோமின், குளோரின், ஆக்ஸிஜன்
பல அணுக்கட்டு எண் :
*பாஸ்பரஸ் (P4), கந்தகம் (S8)
தனிம வரிசை வகைபாடு (Periodic Table) :
மெண்டலீவ் தனிம வரிசை அட்டவணை :
*1869 ம் ஆண்டு இரஷ்ய நாட்டு அறிஞர் மெண்டலீவ் முதல் தனிம வரிசை அட்டவணையைத் தயாரித்தார்.
*மெண்டலீவ் அணுநிறையை அடிப்படையாக கொண்டு வகைப்படுத்தினார்.
நவீன ஆவர்த்தன் விதி (H.J. மோஸ்லே) :
*ஹென்றிஜின் ஜெப்ரிஸ் மோஸ்லே என்பவர் 'x' கதிர்களைப் பயன்படுத்தி தனிமங்களின் அதிர்வெண்ணை அளந்தறிந்தார்.
*பின் அணு எண் அடிப்படையில் தனிமங்களை வகைப்படுத்தினார்.
*அவ்வெண் வர்க்கமூலம், அணு எண் கொண்டு படம் வரைந்தார். வரைபடம் நேராக அமைந்தது.
டொபரினரின் மும்மை விதி :
*ஒத்த பண்புகளைப் பெற்ற தனிமங்களை மும்மூன்று தனிமங்களாக தொகுக்கலாம். தனிமங்களின் ஒரு மும்மையில் உள்ள மையத் தனிமத்தின் அணுநிறை மற்ற 2 தனிமங்களின் அணுநிறைகளின் சராசரியாக அமையும்.
*எ.கா: லித்தியம் 7, சோடியம் 23, பொட்டாசியம் 39
எண்ம விதி :
*நியூலாணட் என்பவர் தனிமங்களை அவற்றின் அணுநிறை அடிப்படையில் ஏறுவரிசையில் அமைத்த போது ஒரு தனிமத்தின் பண்புகளும் அதிலிருந்து எட்டாவது அமைந்த தனிமத்தின் பண்புகளும் ஒத்து இருக்கும்.
*இசைக் குறியீடு சார்ந்து விதி கண்டவர்.
குறைகள் :
*கால்சியத்திற்குப் பின்வரும் தனிமங்களுக்கு இவ்விதி பொருந்தவில்லை.
*பின் கண்டுபிடிக்கப்பட்ட மந்த வாயுக்களுக்கும் இவ்விதம் பொருந்தவில்லை.
தனிம வரிசை அட்டவணை பற்றிய கருத்துக்கள் :
*ஒர் தொகுதியில் கீழ் நோக்கி சென்றால் அணுக்களின் உருவ அளவு அதிகரிக்கும்
*தொடரில் வலது நோக்கி நகர்ந்தால் உருவ அளவு குறையும்.
*தொடரில் இடமிருந்து வலமாக செல்லும் போது அயனியாக்கும் ஆற்றல் அதிகரிக்கிறது.
*தொகுதியில் மேலிருந்து கீழ் நோக்கி செல்லும் போது அயனி ஆக்கும் ஆற்றல் குறைகிறது.
*ஒரு தொடரில் இடமிருந்து வலம் நோக்கிச் செல்லும் போது எலக்டரான் நாட்டம் அதிகரிக்கிறது.
*ஒரு தொகுதியில் மேலிருந்து கீழ்நோக்கி செல்லும் போது எலக்ட்ரான் நாட்டம் குறைகிறது.
திட்ட விகித விதி (மாறாத விகித விதி ) :
*ப்ரௌஸ்ட் என்பவர் வெளியிட்டார். இவ்விதிபடி ஒரு சேர்மம் எம்முறையில் தயாரிக்கப்பட்டாலும் அதில் உள்ள தனிமங்கள் ஒரு குறிப்பிட்ட மாறா எடை விகிதத்தில் தான் இருக்கும்.
*IUPAC அதிகாரப்பூர்வமாக அறிவித்துள்ள இறுதி தனிமம் கோப்பெரன்சியம் (அனுஎண் 112) ஆகும்.
கலவைகள் :
*இரண்டு அல்லது அதற்கு மேற்பட்ட தனிமங்கள் அல்லது சேர்மங்கள் எந்த விகிதத்தில் கலந்து காணப்படும்.
வகைகள் :
ஒரு படித்தான கலவை :
*ஒரே ஒரு நிலைமையில் உள்ளது (நிலைமை என்பது தெளிவான எல்லைகளுக்கு உட்பட்டு மற்ற பகுதிகளில் இருந்து தனிப்பட்டுத் தெரியும் பகுதி ஆகும்) .
*(எ.கா): உலோகக் கலவை, காற்று
பல படித்தான கலவை :
*2 அல்லது அதற்கு மேற்பட்ட நிலைமைகள் கொண்டது.
*(எ.கா): நீருடன் எண்ணெய் கலந்த கலவை.
சேர்மங்களுக்கும் கலவைகளுக்கும் உள்ள வேறுபாடுகள் :
| சேர்மம் | கலவை |
|---|---|
| 1. இரண்டு அல்லது அதற்கு மேற்பட்ட தனிமங்கள் வேதிமுறையில் சேர்ந்து உருவாகுபவை | இரண்டு அல்லது அதற்கு மேற்பட்ட தூய பொருட்கள் கலக்கப்பட்டு உருவாகுபவை |
| 2. உருகுநிலை, கொதிநிலை, அடர்த்தி போன்ற பண்புகளை பெற்றிருக்கும் | உருகுநிலை, கொதிநிலை, அடர்த்தி போன்ற பண்புகளை பெற்றிருக்காது. |
| 3.சேர்மங்களின் தன்மை அதில் காணும் தனிமங்களின் தன்மையிலிருந்து மாறுபட்டவை. | கலவை அதன் பகுதிப் பொருள்களின் தன்மையைப் பெற்றிருக்கும். |
| 4.சேர்மங்கள் ஒரு படித்தானவை. | கலவைகள் பொதுவாக பல படித்தானவை.ஒரு சில கலவைகள் ஒரு படித்தானவை. |
| 5.சேர்மத்தில் உள்ள பகுதி பொருட்களை இயற்பியல் முறைப்படி பிரிக்க முடியாது. | எளிமையான இயற்பியல் முறைகளைப் பயன்படுத்தி கலவையில் உள்ள பகுதி பொருட்களை பிரிக்க இயலும். |
அணு :
*அணு என்பதற்கு கிரேக்கப் பொருள் "உடைக்க முடியாதவை" (அ) பிரிக்க முடியாதவை.
அணுவின் அடிப்படைத்துகள்கள் :
புரோட்டான்கள் :
*கண்டறிந்தவர் கோல்டுஸ்டீன்
*இவை நேர்மின்சுமை உடைய துகள்கள்
*இவை ஒரு அணுவின் உட்கருவினுள் உள்ளன.
எலக்ட்ரான்கள் :
*கண்டறிந்தவர் - J.J. தாம்சன்
*இவை எதிர்சுமை உடையதுகள்கள்
*இத்துகள்கள் உட்கருவை வட்டப்பாதையில் சுற்றி வருகின்றன.
| *ஒலிப்பதிவு செய்யும் முறையை முதன் முதலில் கண்டுபடித்தவர் - எடிசன் |
நியூட்ரான்கள் :
*கண்டறிந்தவர் - சாட்விக்
*இவை நடுநிலையான, மின் சுமையற்ற துகள்கள்.
*இத்துகள்கள் உட்கருவினுள் உள்ளன.
அணுஎண் :
*உட்கருவினுள் உள்ள புரோட்டான்களின் எண்ணிக்கை (அல்லது)
*உட்கருவைச் சுற்றிவருகின்ற எலக்ட்ரான்களின் எண்ணிக்கை என அணு எண்ணை வரையறுக்கலாம்.
நிறை எண் :
*ஓர் அணுவின் உட்கருவில் உள்ளபுரோட்டான்கள் மற்றும் நியூட்ரான்களின்
*எண்ணிக்கைகளின் கூடுதலே, அவ்விணுவின் நிறை எண் ஆகும்.
* நிறை எண் (A) = புரோட்டான்களின் எண்ணிக்கை + நியூட்ரான்களின் எண்ணிக்கை
* N = A - Z
* நியூட்ரான் எண்ணிக்கை = (நிறை எண் - அணு எண்)
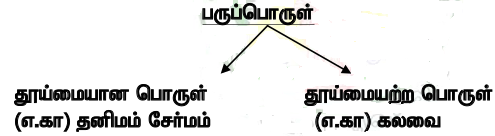
பருப்பொருள் :
*அறிவியல் உலகில் நிறை மற்றும் குறிப்பிட்ட இடத்தை அமைத்துக் கொள்ளும் தன்மை பருப்பொருளாகும்.
பருப்பொருளின் வகைகள் :
| *விழாக்களில் பலூனில் நிரப்பப்படும் வாயு - ஹீலியம் |
| *ஒளிரும் விளக்குகளில் நிரப்பப்படும் வாயு - கிரிப்பான் |
| *விளம்பரங்களில் பயன்படும் குழல் விளக்குகளில் - நியான் |
| *டங்ஸ்டன் விளக்குகளில் - ஆர்கான் |
| *அதிக ஒளிரக் கூடிய விளக்குகளில் - செனான் |
| *பற்களை வலிமையாக வைத்திருக்க பற்பசையில் - ஃபுளுரின் |
| *நீச்சல் குளத்தை சுத்தம் செய்ய - குளோரின் |
| *கதிரியக்க தன்மையுள்ள வாயு - ஆஸ்டாடின் |
| *புவியின் வளிமண்டலத்தில் 21% உள்ள வாயு - ஆக்ஸிஜன் |
